Research
脳は、特定のライフステージの要求に応じて、身体の生理や行動を柔軟に適応させることができます。例えば、身体の成熟と栄養状態が生殖に適した状態になると、性的成熟が開始されます。 乳幼児に対する親の養育行動は、自分の子供が期待される時期に強く促進されます。乳汁分泌を制御する特定の神経活動パターンは、授乳期の母親に特異的に出現します。 これらの例は、生体の内部状態に基づいて脳の入力・出力を柔軟に調整する神経機構の存在を示唆します。しかし、このような適応的な可塑性が神経回路レベルでどのように実現されているかは、ほとんど分かっていません。 そこで私たちは、マウスをモデルに視床下部を基軸として前頭皮質から交感神経系に至る広範な脳領域を対象に、マウスのライフステージに合わせた柔軟な神経機能の発現メカニズムを研究しています。 この目的のために私たちは、一細胞RNAseq、ウイルスを用いた回路マッピング技術、in vivoでの神経活動のイメージング、特定の種類の神経細胞の分子・神経操作を自在に組み合わせて研究を展開しています。 これらの研究により、身体生理や動物の行動制御を支える神経基盤やその可塑性に新たな理解を提供することを目指しています。
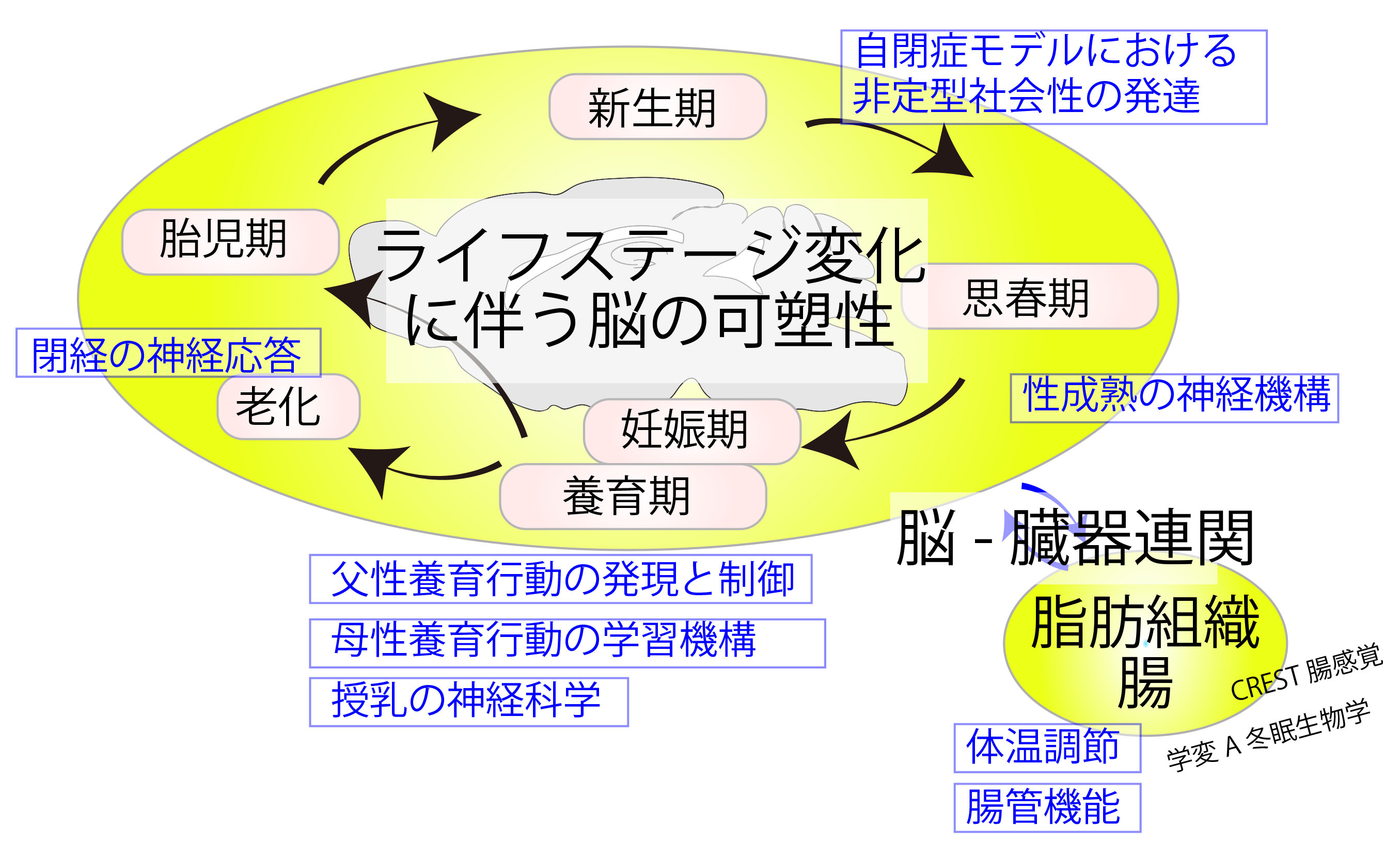
以下には当研究室で現在進行形のテーマを説明しますが、これに限らず、ライフステージや状態の違い(性差、疾患を含む)を反映した脳の可塑性のメカニズムやその理解に資する技術開発全般に興味があります。 これらのテーマについて当研究室で研究を展開したいという方は気軽にPIまでご連絡ください。→ kazunari.miyamichi [at] riken.jp
- 1. 性成熟の制御
生殖は、特に哺乳類の雌にとって重い負担となるため、生殖能力の獲得は身体のエネルギー状態によって厳密に制御されています。栄養失調のような慢性的なエネルギー不足は、性成熟の遅延を招きますが、 その仕組みは十分には理解されていません。 思春期の開始は、性腺機能の制御中枢であるゴナドトロピン放出ホルモン(GnRH)のパルス的な分泌によって支配されており、その分泌のリズムはパルス発生器である視床下部弓状核のキスペプチン神経細胞によって制御されています。 私たちは、スペプチン神経細胞のパルス状活動が食料不足により減少し、この食料不足が解消されるとわずか数時間でこの活動が顕著に回復することを見いだしました。 さらに、空腹を感知する中枢である弓状核のアグーチ関連ペプチド(Agrp)神経細胞が、キスペプチン神経細胞のパルス状活動の頻度を調整し、性成熟のタイミングを制御する役割を持つことを発見しました。 本研究成果は、食事量の変化に応じて生殖中枢の活動を調整する新たな仕組みを見いだし、性と生殖に関する健康の理解に貢献するものです。
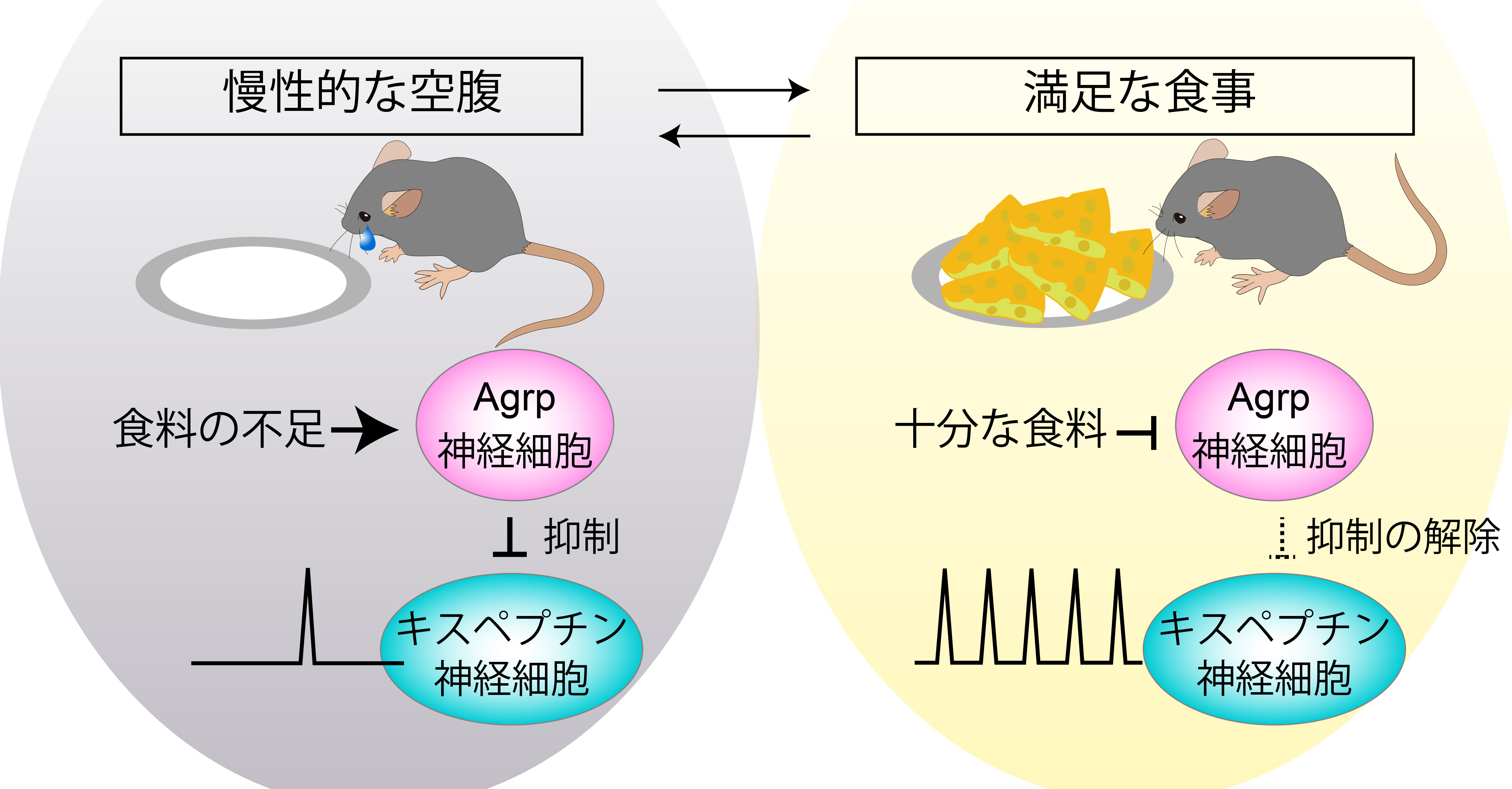
Dietary availability acutely influences puberty onset via a hypothalamic neural circuit.
Goto T#, Hagihara M, Irie S, Abe T, Kiyonari H, Miyamichi K#. Neuron (2025)
DOI: https://doi.org/10.1016/j.neuron.2025.01.015
食料不足により性成熟を阻害する神経回路を解明
- 2. 父性養育行動の発現と制御
交尾を経験していない雄マウスは仔に対して攻撃的ですが、交尾を経て父親になると、一転して仔を温めたり巣から離れた仔を連れ戻したりするなどの養育行動を示すようになります。 私たちは視床下部の室傍核と呼ばれる脳領域でオキシトシンを分泌する神経細胞(オキシトシン神経細胞)に着目しました。この細胞のオキシトシン合成を阻害すると父親マウスが仔を無視するようになり、 逆に神経活動を活性化させると交尾未経験の雄でも養育行動を示したことから、オキシトシン神経細胞が父親マウスの養育行動に必須の役割を持つことが分かりました。さらに、父親マウスの脳内では、 オキシトシン神経細胞が活性化しやすくなるような神経入力の変化が起きていることを明らかにしました。
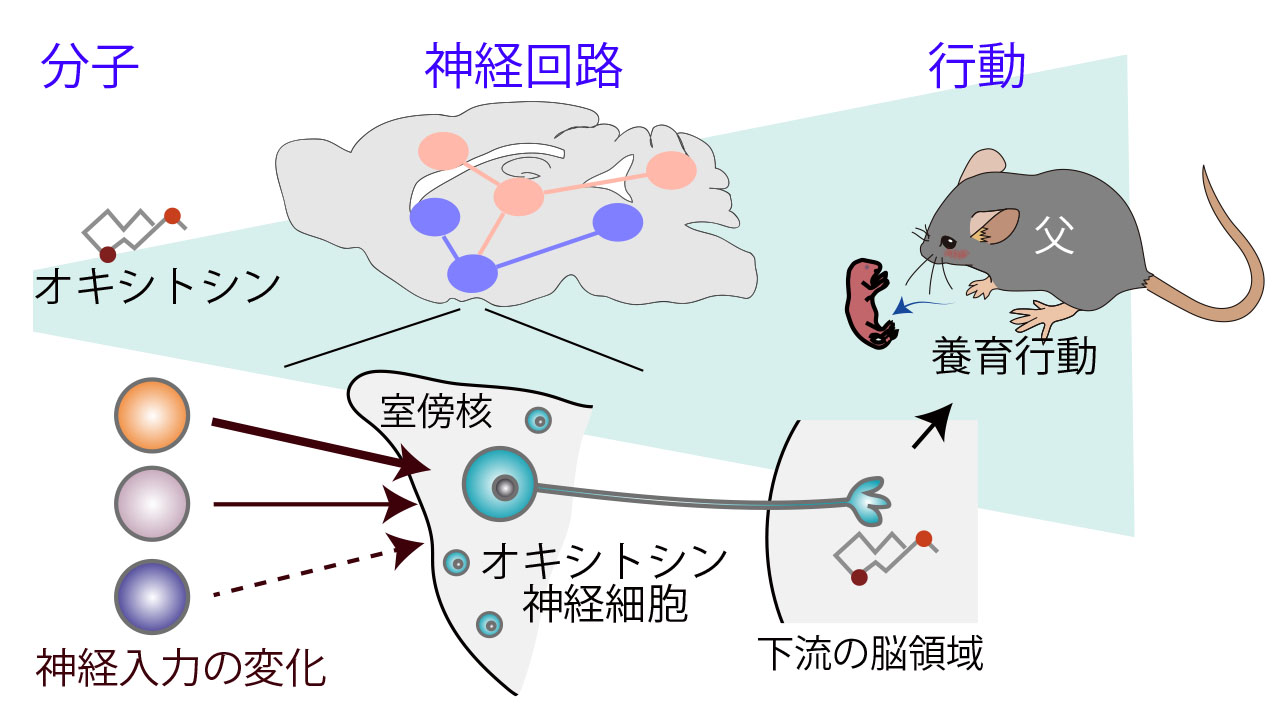
Plasticity of Neural Connections Underlying Oxytocin-mediated Parental Behaviors of Male Mice.
Inada K, Hagihara M, Tsujimoto K, Abe T, Konno A, Hirai H, Kiyonari H, Miyamichi K. Neuron, (2022)
DOI: 10.1016/j.neuron.2022.03.033
父親の子育てを支える神経回路の変化 | 理化学研究所 (riken.jp)
次に私たちは視床下部室傍核に存在するバソプレシンというオキシトシンと類縁のホルモンに着目しました。バソプレシンを合成する神経細胞を除去すると父親マウスの養育行動が阻害され、逆にバソプレシン神経細胞を活性化すると雄マウスの養育行動が促進されました。さらに、視索前野という領域においてオキシトシン受容体の産生を阻害すると、バソプレシンによる父性養育行動の促進効果が消失しました。これらの結果から、室傍核から分泌されるバソプレシンは視索前野のオキシトシン受容体にクロストークシグナルを生じることで父性養育行動を促進することが分かりました。

Vasopressin-to-oxytocin receptor crosstalk in the preoptic area underlying parental behaviors in male mice
,Hagihara M*, Yaguchi K, Irie S, Inoue YU, Inoue T, and .
Nature Communications 16, 10844, 2025.
DOI: 10.1038/s41467-025-66908-0
バソプレシンが父親の子育てを支える仕組み | 理化学研究所 (riken.jp)
- 2’ 満腹感の形成とオキシトシン
食欲は動物の根源的な欲求ですが、脳には過剰な摂食を防ぐ機能も備わっています。マウスは適切な量の餌を食べると、それ以上食べるのをやめますが、これは脳内で食欲を抑制する神経回路が 活性化されるためだと考えられています。この摂食の制御には、オキシトシンの関与が示唆されてきましたが、詳しいことは不明でした。私たちは上記の研究で作出した視床下部の室傍核からオキシトシン遺伝子を コンディショナルにノックアウトしたマウスが過食性の肥満を呈することを見つけました。さらに、弓状核においてオキシトシン受容体をコンディショナルに欠損させても同様の過食性肥満が現れました。 オキシトシンを介した食欲抑制神経回路の存在をはっきりと捉えた本研究成果は、食欲制御の神経基盤を解明する上で重要な知見となります。
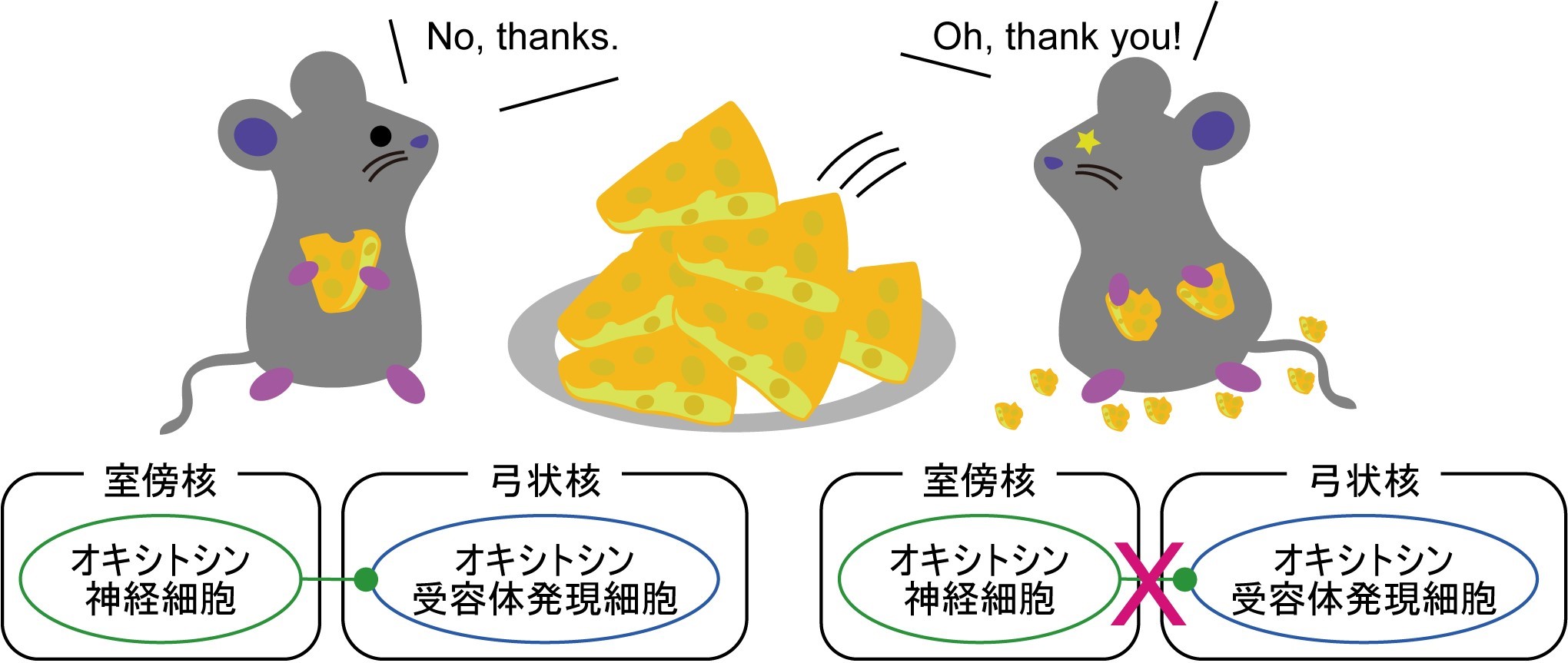
Oxytocin signaling in the posterior hypothalamus prevents hyperphagic obesity in mice.
Inada K, Tsujimoto K, Yoshida M, Nishimori K, Miyamichi K. eLife, (2022) doi: 10.7554/eLife.75718
食べ過ぎを防ぐ脳の仕組み | 理化学研究所 (riken.jp)
- 3. 出産と授乳の神経科学
オキシトシンは出産時の子宮収縮に働くことが知られており、陣痛促進剤として利用されています。また、授乳時には母乳を乳腺から放出させる射乳と呼ばれる機能に必須です。陣痛や射乳に際して、 オキシトシンは数分に1回の波(パルス)として脳下垂体から分泌され、子宮や乳腺に到達しますが、このリズムを作り出す仕組みはよく分かっていません。私たちは、遺伝学ツールの発達したマウスを用いて、 出産や授乳時のオキシトシン神経細胞の活動を詳細に記録することに初めて成功しました。また、オキシトシン神経細胞への入力神経マップを作製し、これを基に特定の神経細胞を活性化することで、 母体におけるオキシトシンの脈動を人為的に操作できることを示しました。
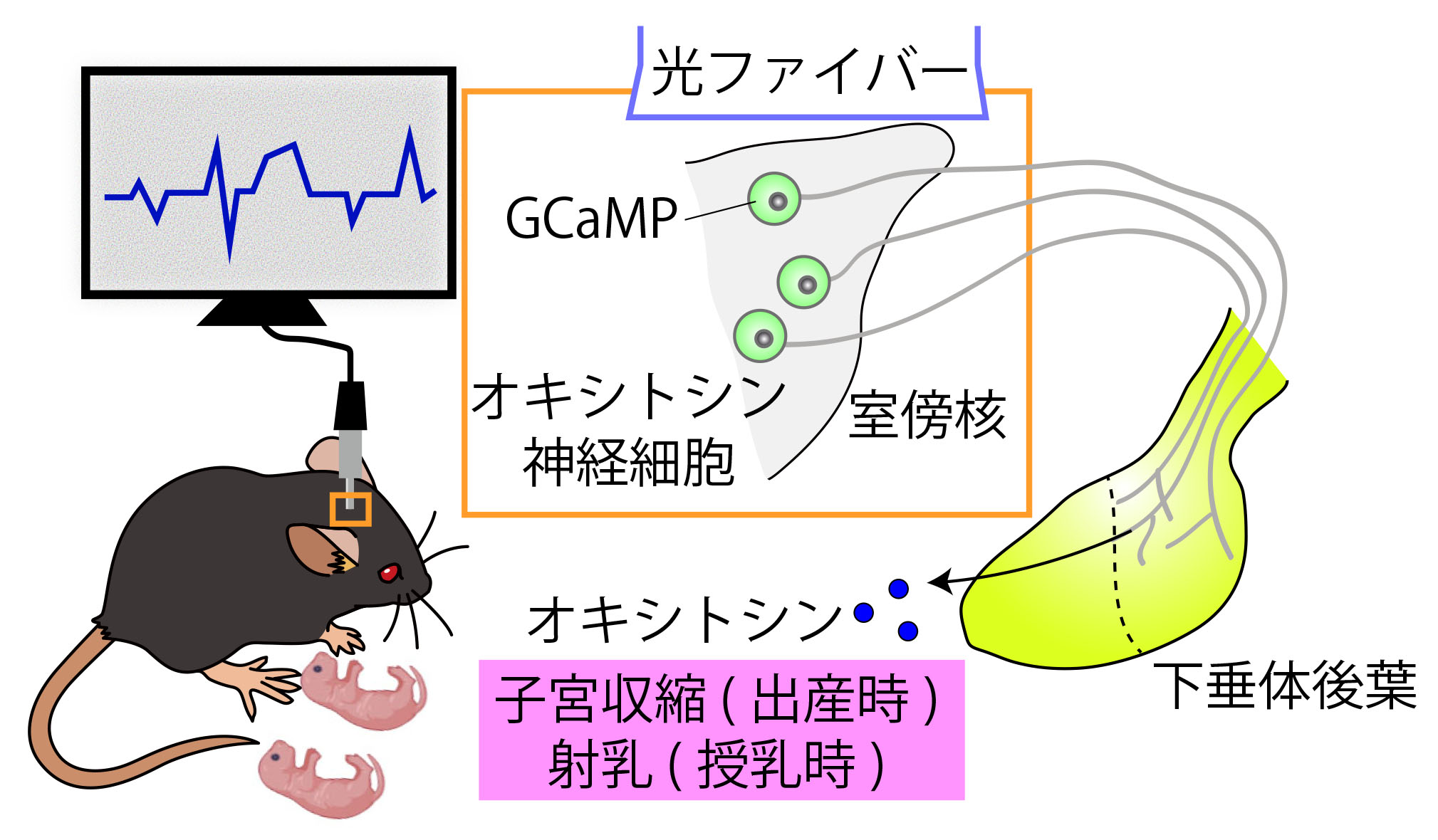
Recording and manipulation of the maternal oxytocin neural activities in mice.
Yukinaga H, Hagihara M, Tsujimoto K, Chiang H-L, Kato S, Kobayashi K, Miyamichi K. Current Biology, (2022) doi: 10.1016/j.cub.2022.06.083
オキシトシン神経細胞の脈動を捉える | 理化学研究所 (riken.jp)
本研究に基づき、私たちはオキシトシン神経細胞の上流の神経活動や遺伝子機能を操作することで、母体において規則正しいパルスが形成される神経回路機構を研究しています。この方向性を促進する第一歩として、 Cre組み換え酵素を使わないシンプルな手法でオキシトシン神経細胞のパルス状活動を効率よく捉える手法を開発しました。
Dynamic modulation of pulsatile activities of oxytocin neurons in lactating wild-type mice.
Yaguchi K, Hagihara M, Konno A, Hirai H, Yukinaga H, Miyamichi K. PLoS One, (2023) doi: 10.1371/journal.pone.0285589
母マウスのオキシトシン神経活動を簡便に記録 | 理化学研究所 (riken.jp)
全身性のノックアウトマウスの研究からオキシトシンは雌マウスの出産や育児に必須ではないことが知られています。私たちは、2.で作出したコンディショナルノックアウトマウスを用いてこれらの点を再評価しました。 その結果、室傍核と視索上核の双方からオキシトシン遺伝子を欠損させても母親マウスの出産や養育行動には強い表現型はありませんでした。次に、古典的によく知られるオキシトシンの機能である授乳を調べると、 室傍核からオキシトシンを欠損させても問題ないが、視索上核のオキシトシン神経細胞の数が200を下回ると重篤な授乳障害が見られました。本研究から、雌マウスのオキシトシンは出産や育児そのものには不可欠でないこと、 視索上核のオキシトシンが射乳反射に不可欠であることが分かりました。これらの知見は、射乳反射の神経メカニズムを探るうえで重要な役割を持つと考えられます。
The importance of oxytocin neurons in the supraoptic nucleus for breastfeeding in mice.
Hagihara M, Miyamichi K, Inada K. PLoS One, (2023) doi: 10.1371/journal.pone.0283152.
上記の研究から、授乳期のオキシトシン神経細胞のパルス状活動は授乳初期に比べて授乳中期に大きく、長くなることが分かっていましたが、背景にある個々の細胞の活動変化は不明でした。そこで内視顕微鏡を用いた一細胞イメージングを新たに確立しました。 その結果、授乳中には多くのオキシトシン神経細胞が一斉にパルス状活動に参加すること、授乳中期では活動する細胞の数が増加し、それぞれの細胞でパルスの波幅も伸びて全体の神経活動が増強することを示しました。 一方、授乳を終えた状態(卒乳)の母マウスは母乳を作れないにもかかわらず、パルス状活動は低いながらも維持されることを見出し、その際には活動する神経細胞の数が減少し、それぞれの細胞のパルスの幅も縮んで基底状態に戻ることを明らかにしました。こうした変化は、仔マウスが必要とする母乳の増える時期にオキシトシン分泌を増加させる仕組みの存在を示唆し、個々のオキシトシン神経細胞が授乳期を通して動的に制御される様子を描出しました。 本研究は自由行動下、リアルタイム、一細胞レベルの神経内分泌学を切り開くものです。

Flexible Adjustment of Oxytocin Neuron Activity in Mouse Dams Revealed by Microendoscopy.
Yaguchi K*, #, Tasaka G*.
Science Advances, Vol 10, Issue 50 2024. DOI: 10.1126/sciadv.adt155
脳内のオキシトシン神経活動を一細胞レベルで可視化 | 理化学研究所 (riken.jp)
- 4. 母性養育行動の学習機構
哺乳類の乳幼児の生存に不可欠な母性養育行動は、しばしば本能行動と言われますが、経験・学習により開始され上達する要素もあります。脳はどのようにして種の存続や個体の生存に重要な行動を効率的に学習できるのか、 神経回路のレベルではまだ十分に理解されていません。養育行動の一般的な回路モデルでは、前頭前皮質ネットワークが子に関連する感覚信号の統合を行い、意思決定や動機付けを実行すると想定されていますが、 これらの仮説は機能的な検証を経ていません。そのため、養育行動に関連する前頭前皮質の詳細な機能はよく分かっていません。私たちは、処女雌マウスを授乳中の母マウスと同居させた場合、眼窩前頭皮質(OFC)が母性養育行動の効率的な学習を促進することを見つけました。自由行動中のマウスから内視顕微鏡を用いて神経活動を記録することで、OFCに仔マウス回収行動に関連して活動する神経細胞が多数存在し、 この神経表象は砂糖水に対する報酬表現と有意に重なり合うことを見出しました。OFCを光・薬理遺伝学的に抑制すると、養育行動学習の初期において、中脳腹側被蓋野のドーパミン神経細胞の活動が低下し、側坐核におけるドーパミンの放出も減少することを突き止めました。 これらの知見から、OFCによるドーパミン放出の増強が効率的な母性養育行動の習得をサポートしていると考えられます。

Orbitofrontal cortex influences dopamine dynamics associated with alloparental behavioral acquisition in female mice.
Tasaka G, Hagihara M, Irie S, Kobayashi H, Inada K, Kobayashi K, Kato S, Kobayashi K, and Miyamichi K.
Science Advances, (2025) doi: 10.1126/sciadv.adr4620
マウスの母性養育行動を促進する神経機構 | 理化学研究所 (riken.jp)
- 5. 閉経の神経応答
更年期は女性の生活に大きな影響を与えますが、閉経の神経機構はまだ十分に解明されていません。生殖腺機能に不可欠なゴナドトロピン放出ホルモン(GnRH)の脈動性分泌は、 主にGnRHのパルス発生器である視床下部弓状核のキスペプチン神経細胞 (ARCkiss) によって制御されています。循環ゴナドトロピン量で評価されるGnRH放出の脈動性は、老化動物で著しく低下しており、 ARCkissの機能不全が生殖器の老化や更年期障害に関与している可能性が示唆されています。しかし、生殖老化への自然な移行過程におけるARCkissの活性動態は分かっていませんでした。 ここでは、ファイバーフォトメトリーによる雌マウスのARCkissの慢性in vivo Ca2+イメージングを導入し、ARCkissのパルス状の同期発火を完全生殖期から非周期期まで 1年間にわたってモニターしました。生殖期には、発情周期の段階によって、個々のパルス状活動の頻度だけでなく、強度や波形も変化することが新たに分かりました。繁殖期から老化期にかけて、 意外にもARCkissのパルス状活動の頻度や波形はほとんど変化しませんでしたが、強度は低下する傾向にありました。これらのデータは、老化した雌マウスにおけるARCkiss活動の時間的ダイナミクスを明らかにするものです。 より一般的には、加齢に伴う機能不全の特徴を明らかにするために、ファイバーフォトメトリー法による脳内神経内分泌調節システムの長期イメージングが有用であることを示しました。
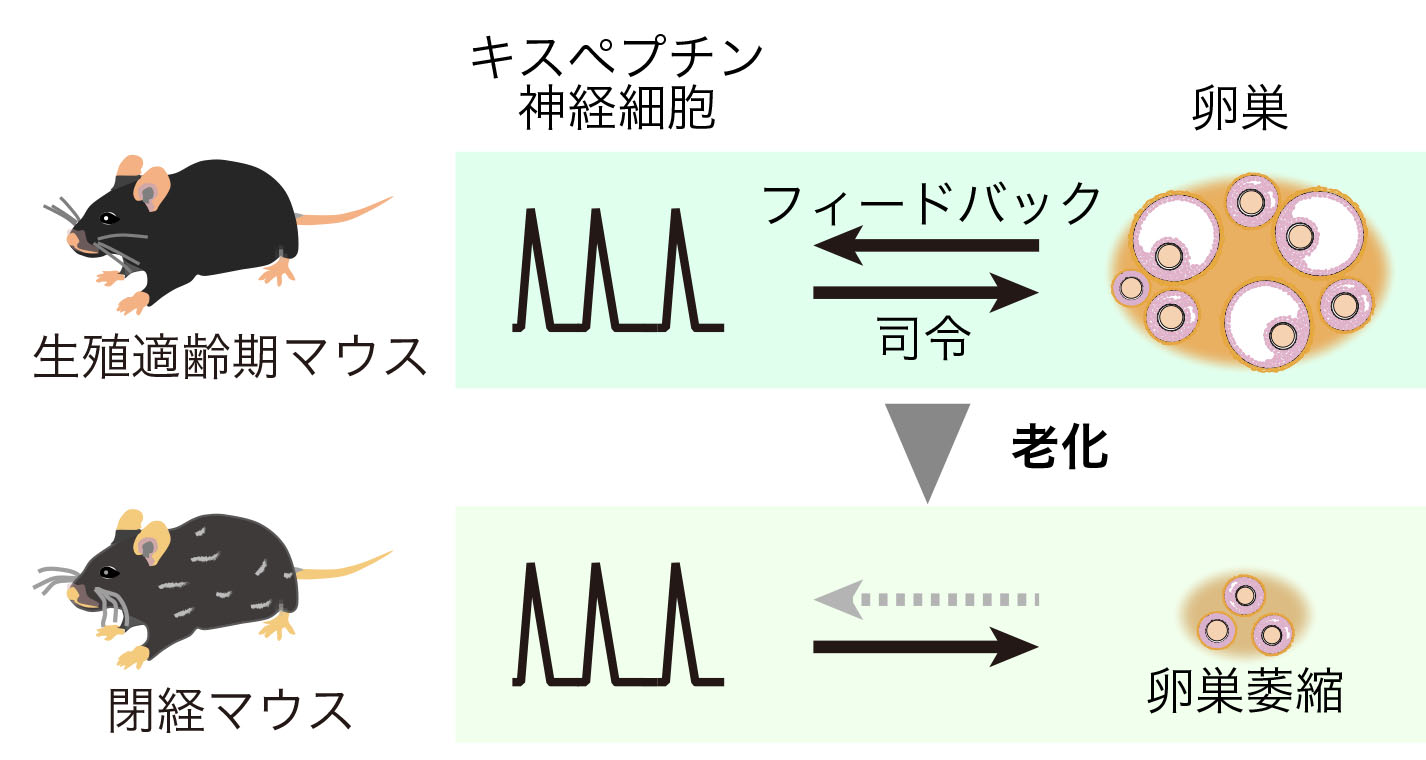
Dynamics of pulsatile activities of arcuate kisspeptin neurons in aging female mice.
Goto T, Hagihara M, Miyamichi K. eLife, (2023) doi: 10.7554/eLife.82533
閉経期マウスの生殖中枢イメージング | 理化学研究所 (riken.jp)
- 6. 発達期の環境因子による社会性発達阻害の神経基盤
社会性の不調を伴う発達障害は、数百種類に上る遺伝的なリスク因子と、母胎内における環境要因とが複雑に交絡(こうらく)して発症に至ると考えられています。そのため、脳の中でどのような神経細胞が機能低下して社会性の不調に至るのかよく分かっていません。 そこで私たちは、環境要因(薬物服用)による社会性不調モデルマウスにおいて、組織学的な観察と網羅的な遺伝子発現パターン解析を用いて、機能低下した神経細胞を探索しました。その結果、社会性行動の制御に重要な小細胞性オキシトシン神経細胞が遺伝子発現パターンの顕著な異常を示し、 オキシトシンを合成できない状態に陥っていることが分かりました。この機能不全は、オキシトシン神経細胞を新生期あるいは思春期に一過的に興奮させることで持続的に回復し、 社会性行動も改善することが判明しました。本研究成果は、自閉スペクトラム症など社会性の不調を伴う発達障害の背景に、特定の神経細胞の脆弱性が潜んでいる可能性を提起し、将来的な治療標的の設定に貢献するものです。
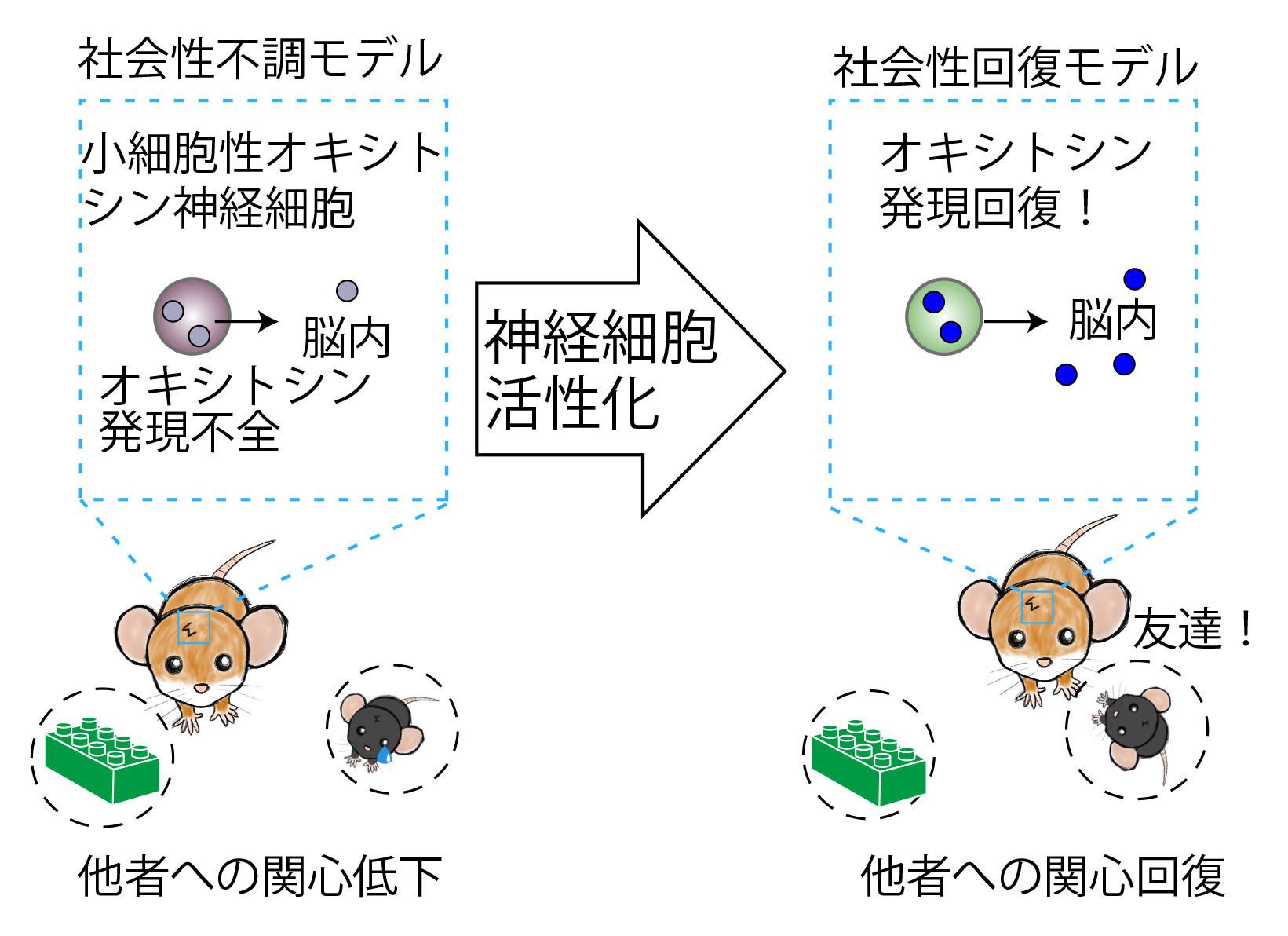
Selective Vulnerability of Parvocellular Oxytocin Neurons in Social Dysfunction.
Tsurutani M, Goto T, Hagihara M, Irie S, Miyamichi K. Nat Commun. 15: 8661 (2024), doi: 10.1038/s41467-024-53092-w.
社会性行動を制御する神経細胞の脆弱性 | 理化学研究所 (riken.jp)
- 7. 脳-臓器連関の研究
視床下部は、神経内分泌系と自律神経系という2つの主要な出力経路を通じて、多様な身体機能と恒常性を調節しています。このうち自律神経系は循環系、呼吸系、消化器系、生殖器系などさまざまな臓器を無意識に制御し、 これらの機能を最適な状態に調節することで、外界の変化に適応し、生命を維持する重要な機能を担っています。神経内分泌系は全身へ一律の指示を送ることしかできませんが、神経系を使うメリットはそれぞれの臓器に個別のきめ細かい指示を出せるところです。 ところが、実際に脳は臓器ごとに個別の制御を行っているのか、それはどのような神経の配線によって成り立っているのか、という根本的な問題が未解明のまま現在に至っています。 私たちの最新の研究は、副腎(内分泌)と腸管運動を制御する下部胸髄をモデルにしてこの問題を解析し、分子的に異なる交感神経のサブタイプがそれぞれ副腎と腸管運動を別々に制御していることを明らかにしました。さらに、糖質が欠乏する状況になると、血糖値を向上させる副腎ルートが特異的に活性化されるのに対し、腸管の制御を担うルートはほとんど活性化されないことも分かりました。この結果は、分子レベルで規定された臓器(群)ごとの交感神経の専用配線が存在することを示しています。 このような構造原理が他の臓器機能に対しても成立するのか、活発な研究が続けられています。
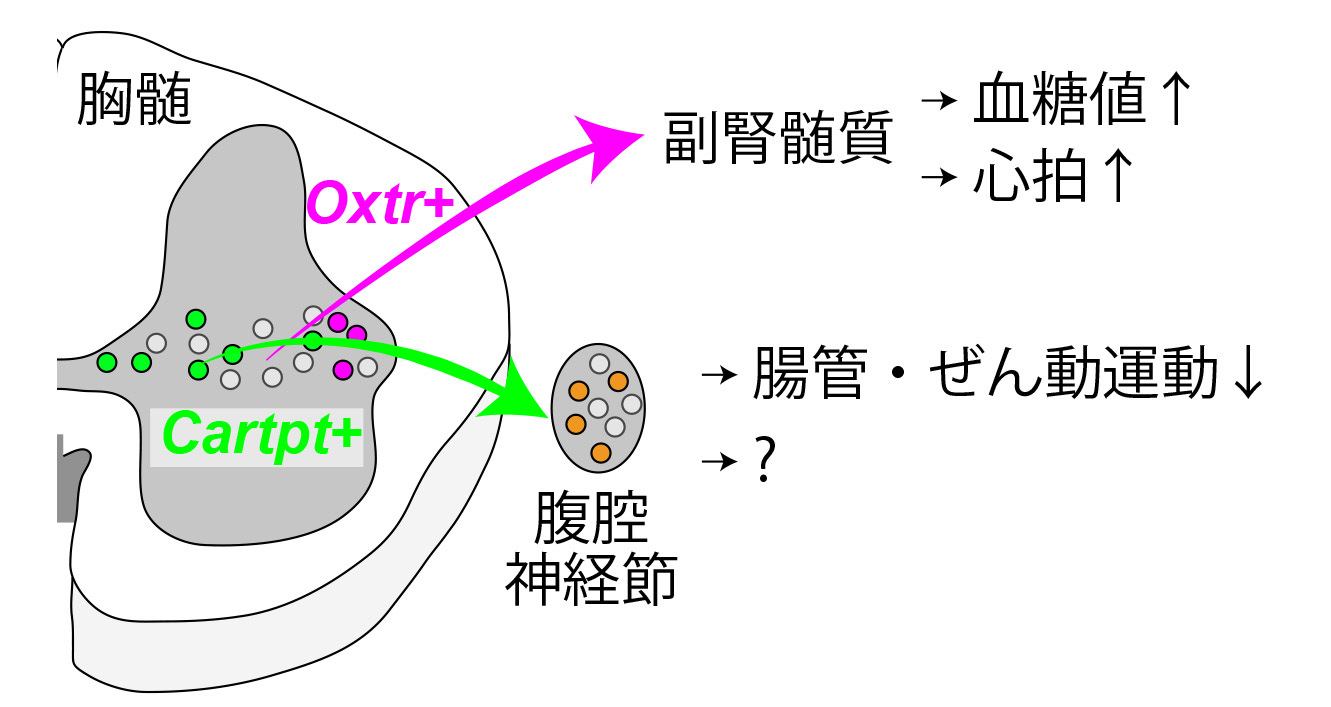
Parallel Labeled-Line Organization of Sympathetic Outflow for Selective Organ Regulation in Mice.
Harima Y, Tsurutani M, Yamada S, Uchida S, Inada K, Hagihara M, Irie S, Shigeta M, Abe T, Inoue YU, Inoue T, Miyamichi K. Nature Communications, (2024) DOI: 10.1038/s41467-024-54928-1
臓器を個別に制御する自律神経の仕組みを解明 | 理化学研究所 (riken.jp)